Hội chứng Down: Thách thức y học lâu đời
Hội chứng Down, hay còn gọi là trisomy 21, là một rối loạn di truyền phổ biến nhất gây ra khuyết tật trí tuệ ở trẻ em. Tình trạng này xảy ra khi một người có ba bản sao của nhiễm sắc thể 21 thay vì hai bản sao bình thường, dẫn đến sự mất cân bằng trong biểu hiện gen và gây ra nhiều vấn đề sức khỏe phức tạp [2].
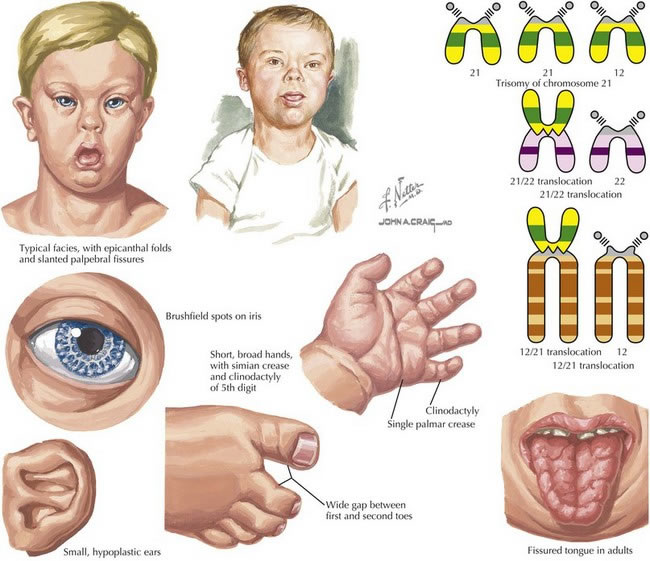
Theo thống kê y học, hội chứng Down ảnh hưởng đến khoảng một trong 700 trẻ sinh ra trên toàn thế giới, khiến nó trở thành nguyên nhân di truyền phổ biến nhất của khuyết tật phát triển trí tuệ [3]. Những người mắc hội chứng Down thường phải đối mặt với nhiều thách thức sức khỏe, bao gồm khuyết tật trí tuệ ở các mức độ khác nhau, dị tật tim bẩm sinh, vấn đề về hệ tiêu hóa, rối loạn thính giác và thị giác, cũng như nguy cơ cao mắc bệnh Alzheimer sớm.
Mặc dù y học hiện đại đã có những tiến bộ đáng kể trong việc chăm sóc và hỗ trợ những người mắc hội chứng Down, giúp cải thiện chất lượng cuộc sống và tăng tuổi thọ, nhưng cho đến nay vẫn chưa có phương pháp điều trị nào có thể giải quyết nguyên nhân cơ bản của tình trạng này. Các can thiệp y tế hiện tại chủ yếu tập trung vào việc quản lý các triệu chứng và biến chứng, chứ không thể loại bỏ nhiễm sắc thể thừa - nguồn gốc của tất cả các vấn đề.
Chính vì vậy, nghiên cứu của nhóm các nhà khoa học Nhật Bản tại Đại học Mie đã mở ra một chân trời hoàn toàn mới trong lĩnh vực này, hứa hẹn những khả năng điều trị mà trước đây chỉ có thể tưởng tượng trong khoa học viễn tưởng.
Nghiên cứu đột phá từ Đại học Mie
Nhóm nghiên cứu được dẫn dắt bởi Tiến sĩ Ryotaro Hashizume từ Trường Đại học Y khoa, Đại học Mie, đã dành nhiều năm nghiên cứu về các kỹ thuật thao tác gen và nhiễm sắc thể. Tiến sĩ Hashizume, một chuyên gia trong lĩnh vực bệnh lý học, di truyền học và y học tái sinh, là thành viên của Đơn vị Phát triển Công nghệ và Thao tác Gen tại trường đại học [4].
Mục tiêu chính của nghiên cứu này không chỉ đơn thuần là chứng minh khả năng kỹ thuật của công nghệ CRISPR, mà còn hướng tới việc phát triển một phương pháp có thể loại bỏ hoàn toàn nguyên nhân gốc rễ của hội chứng Down. Khác với các nghiên cứu trước đây chỉ tập trung vào việc điều chỉnh biểu hiện gen hoặc giảm thiểu tác động của nhiễm sắc thể thừa, nhóm nghiên cứu Nhật Bản đã đặt ra một mục tiêu táo bạo hơn: loại bỏ hoàn toàn nhiễm sắc thể 21 thừa khỏi tế bào.
Điều đặc biệt quan trọng trong nghiên cứu này là việc sử dụng phương pháp "allele-specific" (đặc hiệu alen), một kỹ thuật tiên tiến cho phép nhắm mục tiêu chính xác vào một bản sao cụ thể của nhiễm sắc thể mà không ảnh hưởng đến hai bản sao bình thường còn lại. Đây là một bước tiến vượt bậc so với các phương pháp trước đây, vốn không có khả năng phân biệt giữa các bản sao nhiễm sắc thể và có thể gây tổn hại không mong muốn.
Nghiên cứu được thực hiện trên hai loại tế bào khác nhau: tế bào gốc đa năng cảm ứng (induced pluripotent stem cells - iPSCs) và tế bào sợi (fibroblasts) được lấy từ những người mắc hội chứng Down. Việc lựa chọn hai loại tế bào này không phải ngẫu nhiên - tế bào gốc đa năng đại diện cho tiềm năng ứng dụng trong y học tái sinh, trong khi tế bào sợi là loại tế bào đã biệt hóa và không phân chia, giúp chứng minh tính hiệu quả của phương pháp trên nhiều loại tế bào khác nhau.
Kết quả nghiên cứu, được công bố trên tạp chí khoa học uy tín PNAS Nexus vào ngày 18 tháng 2 năm 2025, đã gây chấn động trong cộng đồng khoa học quốc tế [5]. Đây không chỉ là một bài báo khoa học thông thường, mà là một minh chứng cho khả năng ứng dụng thực tế của công nghệ chỉnh sửa gen trong việc điều trị các bệnh di truyền phức tạp.
Công nghệ CRISPR-Cas9: Chiếc kéo phân tử thế hệ mới
Để hiểu được tầm quan trọng của nghiên cứu này, chúng ta cần tìm hiểu về công nghệ CRISPR-Cas9 - một trong những phát minh quan trọng nhất của thế kỷ 21 trong lĩnh vực sinh học phân tử. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) ban đầu là một hệ thống miễn dịch tự nhiên của vi khuẩn, được các nhà khoa học phát triển thành một công cụ chỉnh sửa gen mạnh mẽ.
Hệ thống CRISPR-Cas9 hoạt động như một "chiếc kéo phân tử" có thể được lập trình để cắt DNA tại những vị trí cụ thể. Thành phần Cas9 đóng vai trò như enzyme cắt, trong khi RNA hướng dẫn (guide RNA) giúp định vị chính xác vị trí cần cắt trên chuỗi DNA. Sự kết hợp này cho phép các nhà khoa học thực hiện những thay đổi chính xác trong bộ gen với độ chính xác chưa từng có.
Tuy nhiên, việc áp dụng CRISPR-Cas9 để loại bỏ toàn bộ một nhiễm sắc thể là một thách thức kỹ thuật cực kỳ phức tạp. Khác với việc chỉnh sửa một gen đơn lẻ, việc loại bỏ một nhiễm sắc thể đòi hỏi phải thực hiện nhiều cắt đồng thời tại các vị trí khác nhau trên nhiễm sắc thể đó, đồng thời đảm bảo không gây tổn hại đến các nhiễm sắc thể khác.
Phương pháp Allele-Specific: Độ chính xác tuyệt đối
Điểm đột phá quan trọng nhất trong nghiên cứu của nhóm Tiến sĩ Hashizume chính là việc phát triển phương pháp "allele-specific multiple chromosome cleavage" (cắt nhiều điểm đặc hiệu alen trên nhiễm sắc thể). Đây là một kỹ thuật tiên tiến cho phép nhắm mục tiêu chính xác vào một bản sao cụ thể của nhiễm sắc thể 21 mà không ảnh hưởng đến hai bản sao bình thường còn lại.
Trong tế bào của người mắc hội chứng Down, có ba bản sao của nhiễm sắc thể 21 - hai bản sao bình thường từ bố và mẹ, cộng với một bản sao thừa. Thách thức lớn nhất là làm thế nào để phân biệt và chỉ loại bỏ bản sao thừa mà không làm tổn hại đến hai bản sao cần thiết cho hoạt động bình thường của tế bào.
Nhóm nghiên cứu đã phát triển một "phương pháp trích xuất chuỗi mục tiêu Cas9 đặc hiệu alen toàn diện" (comprehensive allele-specific Cas9 target sequence extraction method). Phương pháp này dựa trên việc xác định những khác biệt nhỏ trong chuỗi DNA giữa các bản sao nhiễm sắc thể, từ đó thiết kế các RNA hướng dẫn có thể nhận biết và chỉ tác động lên bản sao thừa.
Để tăng hiệu quả của quá trình loại bỏ nhiễm sắc thể, các nhà nghiên cứu còn sử dụng một kỹ thuật bổ sung là "tạm thời ức chế các gen phản ứng tổn thương DNA" (temporary knockdown of DNA damage response genes). Khi tế bào phát hiện có tổn thương DNA (do CRISPR cắt), nó sẽ kích hoạt các cơ chế sửa chữa. Bằng cách tạm thời ức chế những cơ chế này, nhóm nghiên cứu đã tăng đáng kể tỷ lệ thành công trong việc loại bỏ hoàn toàn nhiễm sắc thể thay vì chỉ sửa chữa các vết cắt.
Sự kết hợp giữa độ chính xác của phương pháp allele-specific và hiệu quả được tăng cường thông qua việc điều chỉnh phản ứng tổn thương DNA đã tạo ra một công cụ mạnh mẽ chưa từng có trong lĩnh vực điều trị các bệnh di truyền liên quan đến bất thường nhiễm sắc thể.
Kết quả nghiên cứu: Thành công vượt mong đợi
Kết quả của nghiên cứu đã vượt xa những kỳ vọng ban đầu của cộng đồng khoa học. Nhóm nghiên cứu đã đạt được tỷ lệ thành công lên đến 37,5% trong việc loại bỏ hoàn toàn nhiễm sắc thể 21 thừa khỏi các tế bào được thử nghiệm [6]. Đây là một con số ấn tượng, đặc biệt khi xem xét độ phức tạp kỹ thuật của quá trình này.
Quan trọng hơn cả, các tế bào đã được "cứu" (rescued cells) - những tế bào có nhiễm sắc thể 21 thừa đã được loại bỏ thành công - đã cho thấy sự phục hồi hoàn toàn về mặt chức năng. Các phân tích chi tiết đã chứng minh rằng những tế bào này không chỉ đơn thuần mất đi nhiễm sắc thể thừa, mà còn khôi phục được tất cả các đặc điểm của tế bào bình thường.
Phục hồi biểu hiện gen
Một trong những phát hiện quan trọng nhất là sự bình thường hóa hoàn toàn của mô hình biểu hiện gen trong các tế bào đã được điều trị. Trước khi can thiệp, các tế bào trisomy 21 có mức biểu hiện gen cao bất thường do có ba bản sao của tất cả các gen trên nhiễm sắc thể 21. Sau khi loại bỏ nhiễm sắc thể thừa, mức biểu hiện gen đã trở về mức bình thường, tương đương với các tế bào khỏe mạnh.
Điều này có ý nghĩa cực kỳ quan trọng vì sự mất cân bằng trong biểu hiện gen chính là nguyên nhân gây ra tất cả các triệu chứng của hội chứng Down. Việc khôi phục được cân bằng gen này mở ra khả năng không chỉ ngăn chặn sự tiến triển của bệnh mà còn có thể đảo ngược một số tổn thương đã xảy ra.
Cải thiện chức năng tế bào
Ngoài việc bình thường hóa biểu hiện gen, các tế bào đã được điều trị còn cho thấy sự cải thiện đáng kể trong nhiều chức năng tế bào quan trọng khác. Tốc độ phân chia tế bào, vốn bị chậm lại trong các tế bào trisomy 21, đã được khôi phục về mức bình thường. Điều này rất quan trọng vì tốc độ phân chia tế bào chậm là một trong những yếu tố góp phần vào các vấn đề phát triển ở những người mắc hội chứng Down.
Khả năng chống oxy hóa của tế bào cũng được phục hồi hoàn toàn. Stress oxy hóa là một vấn đề thường gặp trong hội chứng Down và được cho là góp phần vào quá trình lão hóa sớm và nguy cơ cao mắc bệnh Alzheimer ở những người mắc tình trạng này. Việc khôi phục khả năng chống oxy hóa có thể giúp giảm thiểu những rủi ro này.
Hiệu quả trên nhiều loại tế bào
Một khía cạnh đặc biệt ấn tượng của nghiên cứu là tính hiệu quả của phương pháp trên nhiều loại tế bào khác nhau. Kỹ thuật này đã được chứng minh hiệu quả không chỉ trên tế bào gốc đa năng (iPSCs) mà còn trên các tế bào đã biệt hóa như tế bào sợi (fibroblasts).
Điều này đặc biệt quan trọng vì tế bào sợi là loại tế bào không phân chia, đại diện cho phần lớn các tế bào trong cơ thể người trưởng thành. Việc chứng minh hiệu quả trên loại tế bào này mở ra khả năng ứng dụng phương pháp điều trị trên những người đã trưởng thành, không chỉ giới hạn ở giai đoạn phôi thai hoặc trẻ sơ sinh.
Hơn nữa, nhóm nghiên cứu cũng đã chứng minh rằng phương pháp này có thể được áp dụng hiệu quả trên các tế bào thần kinh và tế bào glial - những loại tế bào quan trọng nhất trong hệ thần kinh trung ương và có liên quan trực tiếp đến các vấn đề nhận thức trong hội chứng Down.
Tính ổn định lâu dài
Các thử nghiệm theo dõi dài hạn đã cho thấy rằng những thay đổi tích cực này không chỉ là tạm thời mà có tính ổn định cao. Các tế bào đã được điều trị duy trì được trạng thái bình thường trong suốt thời gian theo dõi, không có dấu hiệu nào cho thấy sự tái xuất hiện của các đặc điểm bất thường.
Ý nghĩa khoa học và tiềm năng ứng dụng
Nghiên cứu của nhóm Tiến sĩ Hashizume không chỉ đơn thuần là một thành tựu kỹ thuật ấn tượng, mà còn đánh dấu một bước ngoặt quan trọng trong cách chúng ta tiếp cận việc điều trị các bệnh di truyền. Đây là lần đầu tiên trong lịch sử y học mà con người có thể loại bỏ hoàn toàn nguyên nhân gốc rễ của một bệnh di truyền phức tạp như hội chứng Down ở cấp độ tế bào.
Bước đột phá so với các nghiên cứu trước đây
Trước nghiên cứu này, tất cả các nỗ lực điều trị hội chứng Down đều tập trung vào việc quản lý triệu chứng hoặc giảm thiểu tác động của tình trạng này. Các phương pháp can thiệp sớm, liệu pháp giáo dục đặc biệt, và điều trị y tế hỗ trợ đã giúp cải thiện đáng kể chất lượng cuộc sống của những người mắc hội chứng Down, nhưng không thể giải quyết được vấn đề cơ bản.
Một số nghiên cứu trước đây đã thử nghiệm việc sử dụng các phương pháp chỉnh sửa gen để điều chỉnh biểu hiện của một số gen cụ thể trên nhiễm sắc thể 21, nhưng những nỗ lực này chỉ có thể giảm thiểu một phần tác động của tình trạng trisomy mà không thể loại bỏ hoàn toàn nguyên nhân gây bệnh.
Nghiên cứu của Đại học Mie đã vượt qua tất cả những hạn chế này bằng cách đi thẳng vào vấn đề cốt lõi: loại bỏ hoàn toàn nhiễm sắc thể 21 thừa. Đây không chỉ là một bước tiến về mặt kỹ thuật mà còn là một thay đổi căn bản trong tư duy tiếp cận điều trị bệnh di truyền.
Tiềm năng ứng dụng lâm sàng
Mặc dù nghiên cứu hiện tại mới chỉ được thực hiện trên các tế bào nuôi cấy trong phòng thí nghiệm, nhưng những kết quả đạt được đã mở ra nhiều hướng ứng dụng lâm sàng tiềm năng trong tương lai.
Liệu pháp tế bào gốc: Một trong những ứng dụng hứa hẹn nhất là việc sử dụng tế bào gốc đa năng đã được điều chỉnh để tạo ra các mô và cơ quan khỏe mạnh cho những người mắc hội chứng Down. Các tế bào gốc này có thể được lấy từ chính bệnh nhân, điều chỉnh để loại bỏ nhiễm sắc thể 21 thừa, sau đó được nuôi cấy và biệt hóa thành các loại tế bào cần thiết như tế bào thần kinh, tế bào tim, hoặc tế bào gan.
Điều trị trong tử cung: Trong tương lai xa hơn, kỹ thuật này có thể được phát triển để can thiệp trực tiếp trong giai đoạn phôi thai. Nếu hội chứng Down được phát hiện sớm thông qua chẩn đoán tiền sản, có thể áp dụng liệu pháp gen để điều chỉnh tình trạng này ngay từ trong tử cung.
Liệu pháp gen in vivo: Mục tiêu dài hạn là phát triển các phương pháp có thể áp dụng trực tiếp trên cơ thể sống, đặc biệt là hệ thần kinh trung ương. Điều này có thể giúp cải thiện chức năng nhận thức và giảm thiểu các vấn đề phát triển ở những người đã mắc hội chứng Down.
Ứng dụng cho các bệnh di truyền khác
Phương pháp allele-specific chromosome elimination được phát triển trong nghiên cứu này không chỉ giới hạn ở hội chứng Down mà còn có thể được áp dụng cho nhiều bệnh di truyền khác liên quan đến bất thường nhiễm sắc thể.
Các hội chứng trisomy khác như hội chứng Edwards (trisomy 18) và hội chứng Patau (trisomy 13) cũng có thể được điều trị bằng phương pháp tương tự. Thậm chí, kỹ thuật này còn có thể được mở rộng để điều trị các bệnh do mất đoạn nhiễm sắc thể hoặc các bất thường cấu trúc nhiễm sắc thể khác.
Tác động đến y học cá nhân hóa
Nghiên cứu này cũng đóng góp quan trọng vào sự phát triển của y học cá nhân hóa. Khả năng điều chỉnh chính xác bộ gen của từng cá nhân mở ra khả năng tạo ra các liệu pháp điều trị được thiết kế riêng cho từng bệnh nhân, dựa trên đặc điểm di truyền cụ thể của họ.
Điều này đặc biệt quan trọng vì hội chứng Down có thể biểu hiện rất khác nhau ở các cá nhân khác nhau, tùy thuộc vào nhiều yếu tố di truyền và môi trường. Việc có thể điều chỉnh chính xác bộ gen sẽ cho phép các bác sĩ tạo ra những phương pháp điều trị tối ưu cho từng trường hợp cụ thể.
Thách thức và hạn chế cần vượt qua
Mặc dù nghiên cứu của Đại học Mie đã đạt được những kết quả đột phá, nhưng con đường từ phòng thí nghiệm đến ứng dụng lâm sàng thực tế vẫn còn nhiều thách thức cần phải vượt qua. Các nhà nghiên cứu đã thẳng thắn thừa nhận những hạn chế hiện tại và những vấn đề cần được giải quyết trước khi công nghệ này có thể được sử dụng để điều trị cho con người.
Vấn đề an toàn và tác dụng phụ
Một trong những mối quan tâm lớn nhất là khả năng gây ra các đột biến không mong muốn trong bộ gen. Mặc dù phương pháp allele-specific đã được thiết kế để chỉ nhắm mục tiêu vào nhiễm sắc thể 21 thừa, nhưng vẫn tồn tại nguy cơ CRISPR-Cas9 có thể tác động đến các vị trí khác trong bộ gen, gây ra những thay đổi không mong muốn.
Các nghiên cứu bổ sung đã chỉ ra rằng quá trình loại bỏ nhiễm sắc thể có thể gây ra một số thay đổi nhỏ ở các nhiễm sắc thể còn lại [7]. Mặc dù những thay đổi này có vẻ không gây ra tác hại nghiêm trọng trong các thử nghiệm ngắn hạn, nhưng tác động lâu dài của chúng vẫn chưa được hiểu rõ hoàn toàn.
Để giải quyết vấn đề này, các nhà nghiên cứu đang phát triển các phương pháp phân tích toàn bộ bộ gen (whole-genome sequencing) để theo dõi và đánh giá mọi thay đổi có thể xảy ra. Họ cũng đang nghiên cứu các cách để tăng độ chính xác của CRISPR-Cas9 và giảm thiểu nguy cơ tác động ngoài mục tiêu.
Thách thức trong việc chuyển giao vào cơ thể sống
Việc áp dụng kỹ thuật này trên các tế bào nuôi cấy trong phòng thí nghiệm là một chuyện, nhưng việc chuyển giao nó vào cơ thể sống lại là một thách thức hoàn toàn khác. Cơ thể người có hệ thống miễn dịch phức tạp có thể phản ứng với các thành phần của hệ thống CRISPR, đồng thời việc đưa công cụ chỉnh sửa gen đến đúng các tế bào mục tiêu trong cơ thể cũng là một vấn đề kỹ thuật phức tạp.
Đặc biệt khó khăn là việc đưa CRISPR vào hệ thần kinh trung ương, nơi mà các tác động của hội chứng Down thường nghiêm trọng nhất. Hàng rào máu-não (blood-brain barrier) là một cơ chế bảo vệ tự nhiên ngăn cản hầu hết các chất từ máu xâm nhập vào não, bao gồm cả các công cụ chỉnh sửa gen.
Vấn đề đạo đức và xã hội
Nghiên cứu này cũng đặt ra nhiều câu hỏi đạo đức phức tạp. Việc có thể "chữa khỏi" hội chứng Down có thể dẫn đến những áp lực xã hội đối với các gia đình có con mắc tình trạng này. Có lo ngại rằng sự tồn tại của liệu pháp điều trị có thể làm giảm sự chấp nhận và hỗ trợ dành cho những người hiện đang sống với hội chứng Down.
Cộng đồng người khuyết tật và các tổ chức ủng hộ quyền của những người mắc hội chứng Down đã bày tỏ những quan điểm khác nhau về nghiên cứu này. Một số người hoan nghênh tiềm năng cải thiện chất lượng cuộc sống, trong khi những người khác lo ngại về thông điệp ngầm rằng hội chứng Down là một "bệnh" cần được "chữa khỏi".
Thời gian và chi phí phát triển
Ngay cả khi tất cả các vấn đề kỹ thuật và an toàn được giải quyết, việc đưa công nghệ này vào ứng dụng lâm sàng vẫn cần một thời gian rất dài. Các thử nghiệm tiền lâm sàng trên động vật, theo sau là các giai đoạn thử nghiệm lâm sàng trên người, có thể mất từ 10-15 năm hoặc thậm chí lâu hơn.
Chi phí phát triển cũng là một yếu tố quan trọng. Việc nghiên cứu và phát triển các liệu pháp gen thường đòi hỏi nguồn đầu tư khổng lồ, và điều này có thể ảnh hưởng đến khả năng tiếp cận của bệnh nhân trong tương lai.
Cần thiết phải có nghiên cứu dài hạn
Một thách thức quan trọng khác là việc đánh giá tác động lâu dài của liệu pháp. Hội chứng Down ảnh hưởng đến nhiều hệ thống cơ quan khác nhau và có những biểu hiện thay đổi theo thời gian. Việc hiểu rõ liệu pháp gen có thể ngăn ngừa hoặc đảo ngược được những thay đổi này đến mức nào đòi hỏi các nghiên cứu theo dõi dài hạn.
Đặc biệt, cần phải nghiên cứu xem liệu pháp có thể ngăn ngừa được các biến chứng muộn của hội chứng Down như bệnh Alzheimer sớm hay không. Điều này đòi hỏi các nghiên cứu kéo dài hàng thập kỷ để có thể đưa ra kết luận chắc chắn.
Kết luận: Bước đầu của một cuộc cách mạng y học
Nghiên cứu của nhóm Tiến sĩ Ryotaro Hashizume tại Đại học Mie đã mở ra một chương mới trong lịch sử y học, đánh dấu lần đầu tiên con người có thể loại bỏ thành công nguyên nhân gốc rễ của hội chứng Down ở cấp độ tế bào. Với tỷ lệ thành công 37,5% và khả năng phục hồi hoàn toàn chức năng tế bào, nghiên cứu này không chỉ là một thành tựu kỹ thuật ấn tượng mà còn là minh chứng cho tiềm năng to lớn của công nghệ chỉnh sửa gen trong việc điều trị các bệnh di truyền.
Phương pháp allele-specific multiple chromosome cleavage được phát triển trong nghiên cứu này đại diện cho một bước tiến vượt bậc so với tất cả các nỗ lực trước đây. Khả năng nhắm mục tiêu chính xác vào nhiễm sắc thể 21 thừa mà không ảnh hưởng đến các nhiễm sắc thể bình thường đã giải quyết được một trong những thách thức lớn nhất trong lĩnh vực chỉnh sửa gen.
Tuy nhiên, con đường từ phòng thí nghiệm đến giường bệnh vẫn còn dài và đầy thách thức. Các vấn đề về an toàn, hiệu quả, đạo đức và chi phí cần được giải quyết cẩn thận trước khi công nghệ này có thể được ứng dụng rộng rãi. Điều quan trọng là cộng đồng khoa học, các nhà hoạch định chính sách, và xã hội cần phải cùng nhau thảo luận và đưa ra những quyết định sáng suốt về cách thức phát triển và ứng dụng công nghệ này.
Đối với hàng triệu gia đình trên thế giới đang sống với hội chứng Down, nghiên cứu này mang lại một tia hy vọng mới. Mặc dù liệu pháp điều trị thực tế có thể vẫn còn cách xa nhiều năm, nhưng việc chứng minh được khả năng loại bỏ nguyên nhân gây bệnh đã mở ra những khả năng mà trước đây chỉ có thể tưởng tượng.
Quan trọng hơn cả, nghiên cứu này nhắc nhở chúng ta về sức mạnh của khoa học và công nghệ trong việc giải quyết những thách thức y học phức tạp nhất. Nó cũng khẳng định rằng với sự kiên trì, sáng tạo và hợp tác quốc tế, con người có thể vượt qua những giới hạn mà trước đây được cho là không thể vượt qua.
Trong tương lai, khi nhìn lại lịch sử y học, nghiên cứu của Đại học Mie có thể sẽ được ghi nhận như một trong những cột mốc quan trọng nhất trong cuộc chiến chống lại các bệnh di truyền. Nó không chỉ mở ra hy vọng cho những người mắc hội chứng Down mà còn cho hàng triệu người khác đang sống với các bệnh di truyền khác trên toàn thế giới.
Tài liệu tham khảo
[1] Mie University. (2025, February 19). Innovative Approach Developed for Removing Extra Chromosome 21 in Cells from Individuals with Down Syndrome Using CRISPR-Cas9 Genome Editing Technology. https://www.mie-u.ac.jp/en/R-navi/release/medic/innovative-approach-developed-for-removing-extra-chromosome-21-in-cells-from-individuals-with-down-s.html
[2] Antonarakis, S. E., et al. (2020). Down syndrome. Nature Reviews Disease Primers, 6(1), 9.
[3] Stallings, E. B., et al. (2024). National population-based estimates for major birth defects, 2016–2020. Birth Defects Research, 116(1), e2301.
[4] Mie University Graduate School of Medicine. (2025). Researcher Profile: Ryotaro Hashizume. https://www.mie-u.ac.jp/en/R-navi/release/medic/innovative-approach-developed-for-removing-extra-chromosome-21-in-cells-from-individuals-with-down-s.html
[5] Hashizume, R., et al. (2025). Trisomic rescue via allele-specific multiple chromosome cleavage using CRISPR-Cas9 in trisomy 21 cells. PNAS Nexus, 4(2), pgaf022. https://pubmed.ncbi.nlm.nih.gov/39967679/
[6] SciTechDaily. (2025, February 23). CRISPR Snips Away Extra Chromosomes, Offering New Hope for Down Syndrome Treatment. https://scitechdaily.com/crispr-snips-away-extra-chromosomes-offering-new-hope-for-down-syndrome-treatment/
[7] DSA Achieves. (2025, March 19). Unlocking New Possibilities: Gene Editing and Down Syndrome. https://dsachieves.org/2025/03/19/unlocking-new-possibilities-gene-editing-and-down-syndrome/








